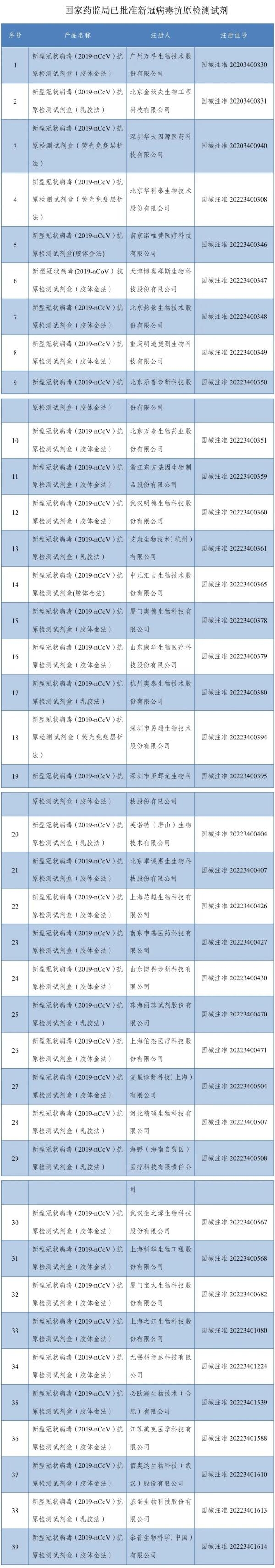
体外诊断厂商须知:事关新冠检测产品·FDA会议问答Q&A
在家COVID-19抗原测试,如何降低假阴性结果?
开场议题是关于FDA网站上发布的标题:“At‐Home COVID‐19 Antigen Tests‐Take Steps to Reduce Your Risk of False Negative Results”(在家COVID-19抗原测试-采取措施降低假阴性结果的风险)。其本意是:号召民众多次检测以收集多次数据用于评估产品假阴性率。
FDA建议:重复多次抗原测试以提高测试结果的准确性,该措施适用有症状和无症状的个体。

久顺总结:
无新冠症状且首测为阴性结果者:建议检测3次,每次检测间隔48小时,以确认阴性结果。
有新冠症状且首测为阴性结果者:建议检测2次,期间相隔48小时,以确认阴性结果。
再加上美联邦政府宣布:免费的家庭COVID-19测试于9月2日结束。
多次抗原测试+免费时代结束,对民众意味着将增加新冠检测的花销。因此,许多美国民众在推特上表达自己的不理解和不满。
FDA将联系所有抗原测试制造商,以提供有关上述方法的更多信息,最终此重任落到了各制造商。

会议回答Q&A
Q1:
1.1 FDA是否接受EUA要求的多重抗原测试,例如SARS-CoV-2和流感可否用于非处方的情况?
1.2 流感和COVID多重分子检测,除COVID外是否需单独调用甲型流感和乙型流感,或者是否可将甲型流感和乙型流感合并为一般流感?
A1:
1.1 FDA已授权几项用于实验室和护理点的抗原多分析物诊断测试。目前未授权多分析物非处方测试,但FDA已通过合适的模板提供建议,并且该类测试确实符合当前优先事项。
FDA曾指出,如果制造商正考虑进行非处方多分析物测试,建议提交预EUA以进一步讨论测试设计和提案。
1.2 关于流感和COVID及甲型流感和乙型流感的单独调用,市场上有许多甲型\乙型流感快速抗原检测,都可区分甲型流感和乙型流感。
因此,FDA建议是:支持单独报告甲型和乙型流感结果,因为甲型和乙型流感结果的风险和益处不相同。
Q2:
2.1 现在向FDA提交Pre-EUA审查是否为时已晚?
2.2 如果EUA途径即将结束,是否只需提供更多数据就可将Pre-EUA转换为510(k)?FDA是否会发布批准方式转换的指南草案?
A2:
2.1 现在提交Pre-EUA或EUA请求以供FDA审查,为时未晚。
2.2 正如FDA之前在会议所发表的意见,FDA无法预测公共卫生紧急事件结束时间,但FDA正为EUA制定过渡计划。
除非被撤销,否则EUA将持续有效,直到公共卫生紧急事件564声明终止。
Q3:
Color Health的Anjali Zimmer提问,FDA对猴痘诊断等器械是否可能采取 EUA途径?
A3:
FDA愿意与开发人员合作进行猴痘测试相关内容的讨论,并始终可接受Pre-EUA。

Q4:
Hopkins MedTech Compliance的Homer Wu提问,其公司提交的COVID-19+甲型流感和乙型流感的非处方多联检产品Pre-EUA,等待将近四个月时间才得到答复并且仍然有关于乙型流感的问题。
FDA允许在其他国家(例如南美国家)进行乙型流感临床研究吗?
A4:
FDA希望确保该产品类似于美国用户能体验到的典型产品。
因此,FDA对该提案持开放态度,针对更多细节FDA建议发送一份补充Pre-EUA资料。如果有建议和具体问题,FDA非常愿意在补充材料中解决这些问题。
Q5:
Seungjin的Gina提问,其公司正根据EUA流程申请带有COVID-19抗原及甲型和乙型流感病毒的抗原检测试剂盒,也在按510(k)流程开发针对甲型和乙型流感的抗原检测试剂盒。正试图在同一程序下,同时由IRB按照临床试验方案操作,用这两种检测试剂盒进行临床试验。
如果从患者身上采集的拭子样本被添加到含有缓冲液的提取物的试剂管中,制造商将同时对这两个试剂盒使用同一个拭子和缓冲液。
在IRB批准下,FDA是否可用或可接受这两种试剂盒同时进行临床试验?
A5:建议开展抽样计划,首先进行流感和COVID-19,然后单独进行流感及随机方案。
在这两种情况下,一种是使用相同的抽象缓冲区,另一种是提供抽样计划以最大限度减少两个候选测试的偏差。
→ 欢迎点击上方粉我~关注【久顺医械技术服务】医械资讯不迷路!
[注:本文部分图片来自互联网!未经授权,不得转载!每天跟着我们读更多的书]
互推传媒文章转载自第三方或本站原创生产,如需转载,请联系版权方授权,如有内容如侵犯了你的权益,请联系我们进行删除!
如若转载,请注明出处:http://www.hfwlcm.com/info/141294.html