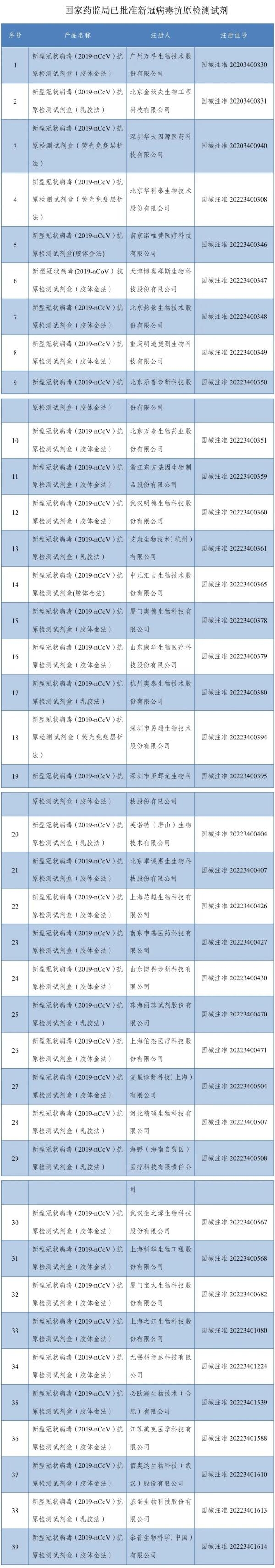
国产抗新冠小分子药VV116上市申请获受理,完成Paxlovid对比试验
解放日报·上观新闻记者今天从上海企业君实生物获悉,国家药品监督管理局已受理国产口服核苷类抗新型冠状病毒药物——氢溴酸氘瑞米德韦片(产品代号:VV116/JT001)新药上市申请,用于新冠病毒感染患者的治疗。
VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、中国科学院中亚药物研发中心/中乌医药科技城(科技部“一带一路”联合实验室)、临港实验室、旺山旺水和君实生物共同研发。君实生物与旺山旺水共同承担该药物在全球层面的临床开发和产业化工作。
这款口服小分子药物能够以三磷酸形式非共价结合到新冠病毒RNA(核糖核酸)聚合酶的活性中心,直接抑制病毒RNA聚合酶的活性,阻断子代病毒的复制,从而实现抗病毒的效果。
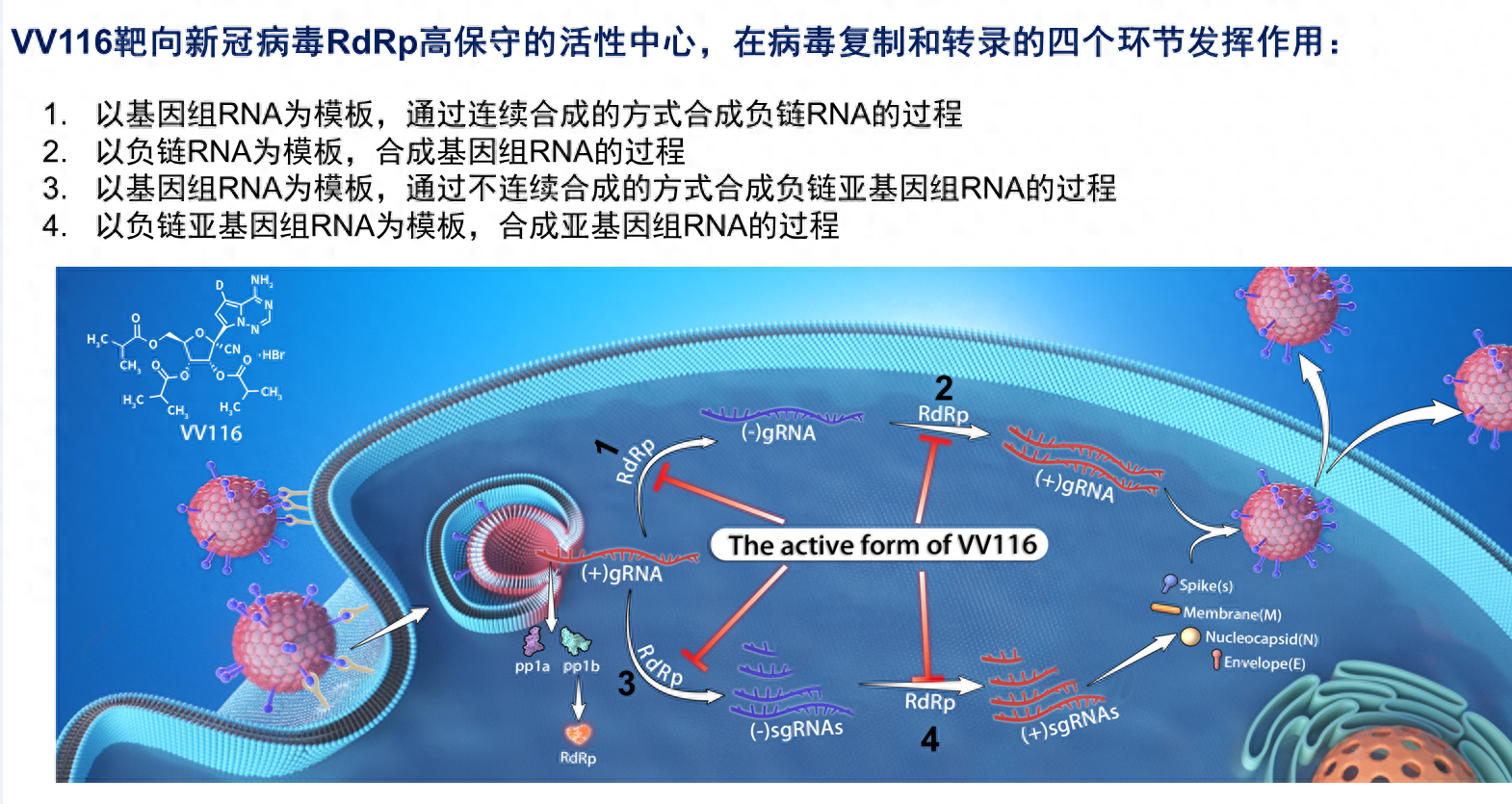
VV116作用机理图示
临床前药效学研究显示,VV116在体外对包括奥密克戎在内的新冠病毒原始株和突变株表现出显著的抗病毒作用;在小鼠模型上,低剂量的VV116就可将肺部病毒滴度降低至检测限以下,显著改善肺组织病理变化,表现出较强的抗病毒功效。临床前的药代动力学等研究结果显示,它具有很高的口服生物利用度,口服吸收后迅速代谢为母体核苷,并在体内组织广泛分布。
2021年11月,VV116的新药临床试验申请获得国家药监局批准。随后开展的3项Ⅰ期临床研究显示,VV116表现出令人满意的安全性、耐受性和药代动力学性质,口服吸收迅速。一项VV116对比奈玛特韦片/利托那韦片(Paxlovid)用于伴有进展为重症(包括死亡)高风险因素的轻中度新冠感染患者早期治疗的Ⅲ期临床研究,显示与Paxlovid相比,VV116组的临床恢复时间更短,安全性方面的顾虑更少。近日,这项研究成果在全球权威医学期刊《新英格兰医学杂志》上发表。

《新英格兰医学杂志》论文截图
2022年10月,一项在伴或不伴有进展为重症高风险因素的轻中度新冠感染患者中评价VV116有效性和安全性的多中心、双盲、随机、安慰剂对照、Ⅲ期临床研究完成首例患者入组及给药。这项研究由浙江大学医学院李兰娟院士牵头,在全国32家中心开展。目前,已完成方案预设的期中分析,经独立数据监察委员会判定,已达成方案预设规定的主要有效性终点。这项研究的详细数据,君实生物今后将公布。
栏目主编:黄海华
来源:作者:俞陶然
[注:本文部分图片来自互联网!未经授权,不得转载!每天跟着我们读更多的书]
互推传媒文章转载自第三方或本站原创生产,如需转载,请联系版权方授权,如有内容如侵犯了你的权益,请联系我们进行删除!
如若转载,请注明出处:http://www.hfwlcm.com/info/291604.html