基因检测能否延长癌症患者的生命?
在决定治疗方案时,先进行基因检测,这在肺癌治疗领域已成为共识。不过,肿瘤基因检测的产品获批、商业化,还需国内公司通过长期随访、病例积累,自证临床价值

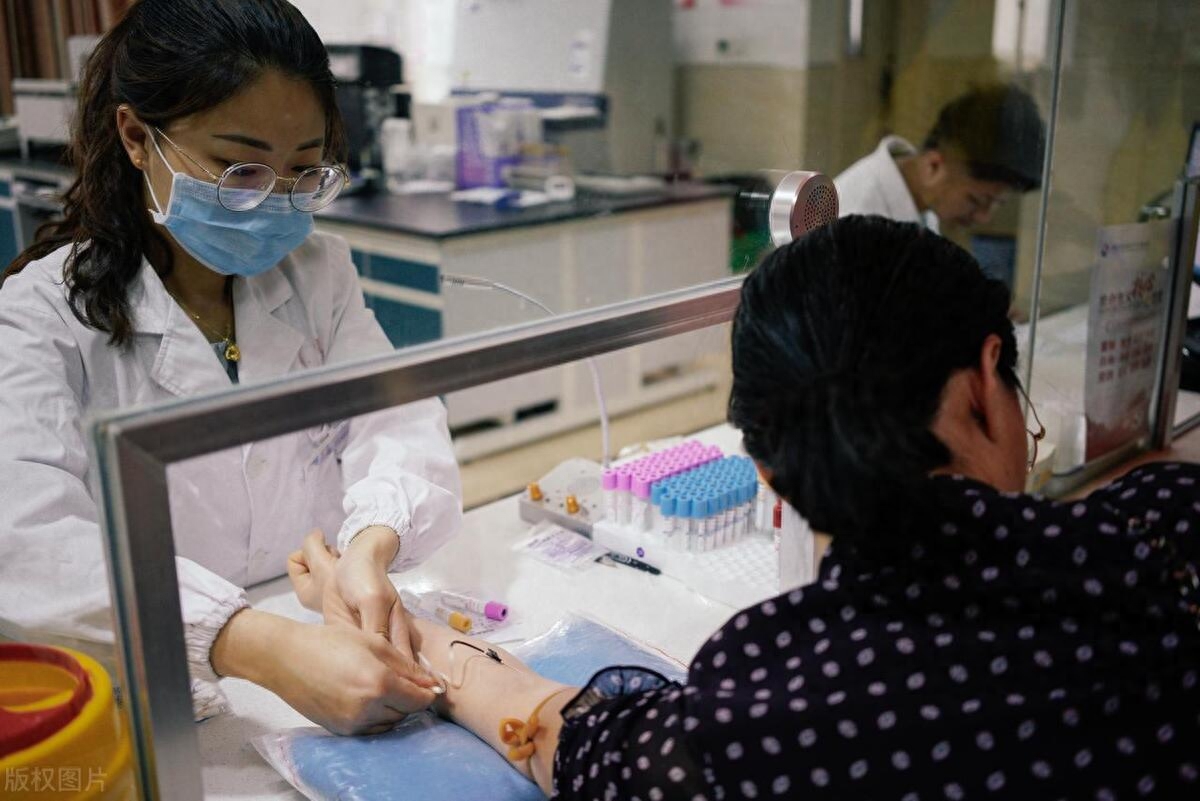
(在决定治疗方案时,先进行基因检测,这在肺癌治疗领域已成为共识,美国、欧洲、中国等的医生组织均制定了相应的共识文件。图/视觉中国)
《财经》记者 孙爱民/文 王小/编辑
65岁的癌症晚期患者王卓武(化名),在一年零九个月的抗癌战斗中,曾做过三次基因检测。
他的每个治疗方案都由基因检测来决定。第一次做基因检测,未发现基因突变,于是采用化疗、放疗,经三个月虽有好转,但却发生肿瘤转移;第二次检测,突变的基因现出原形,治疗方案改为服用靶向药物,十天后他的脑部肿瘤缩小;半年后,做第三次检测发现肿瘤产生耐药性,他不得不更换靶向药物。
王卓武是幸运的,能用基因检测锁定驱动基因,找到靶向药物。他的诊疗经历,是最新的癌症治疗的一个缩影:基于二代测序的基因检测,让医生在决定部分癌症的用药、监控肿瘤时,有了新“帮手”。
不过,王卓武的诊疗案例,在2017年12月一个精准治疗学术论坛上,还是引发了不小的争议。一方认为,患者从精准治疗、基因检测中受益,遗憾的是患者每段治疗都非常短;另一方质疑,第一次基因检测未发现基因突变,检测方法是否合理值得推敲。
争议背后的原因是,针对肿瘤的基因检测还在摸索阶段,缺乏长期随访临床案例,再加上各检测平台差异性太大,国内监管机构难以认可其临床价值。
“裸奔”之下,类似王卓武尝试的检测技术,国内至少已经完成数万例。走在灰色地带的癌症基因检测行业,已经多轮融资,布局者争相签约医院、推动临床试验,试图叩开监管之门。
门后,是标准、规范,更有巨大的商业利益。
初露威力
2017年8月,王卓武去世。
当医生们坐在一起讨论他的诊疗过程时,质疑的是王卓武的第一次基因检测没有发现基因突变,会不会是假阴性,耽误了初始治疗?
面对同行们的疑问,王卓武的主治医生也无法给出确定的答案,“到底患者是治疗过程当中发生了转化,还是检测结果有问题”?
后两次检测的临床价值,得到专家们的普遍认可:第二次多基因检测报告,发现EGFR敏感基因突变,还推荐了靶向药物。在服用靶向药物十天后,王卓武脑部的症状便得到改善。
第三次检测还为监控肿瘤的发展出了一把力——发现新的基因突变和肿瘤产生耐药性。基于此,医生更换了靶向药物。
王卓武患的是非小细胞肺癌。这种癌约占所有肺癌的80%,约75%的患者发现时已处于中晚期。他的诊疗,遵循了《非小细胞肺癌血液EGFR基因突变检测中国专家共识》推荐的流程。该共识建议,不管患者的肿瘤组织标本是否容易获取,最终都要进行EGFR基因的突变检测。
美国肿瘤专家也有同样的共识。美国国家综合癌症网络(NCCN)建议:为癌症晚期患者做组织病理的同时,再做一次分子病理的基因检测;如发现驱动基因,给予靶向治疗。
在决定治疗方案时,先进行基因检测,这在肺癌治疗领域已成为共识,美国、欧洲、中国等的医生组织均制定了相应的共识文件。为节约组织、省去患者多次穿刺取样的痛苦,NCCN建议做多基因、大Panel的检测。王卓武进行的第二次、第三次检测,采用的正是这种检测。
《财经》记者梳理发现,国内不少公司开发了多基因多癌种的测序平台,其中不乏能检测300多个、甚至400多个基因的测序服务,可实现“撒网”搜寻突变基因。
但这些检测平台并没有获得国家食药监总局(CFDA)审批,而是以临床服务的形式在运作:医生开单子、推荐检测公司与产品,患者到检测公司的临床检验中心完成检测,形成的检测报告,为医生诊疗决策提供支持。
美国情况相仿,但在2017年11月16日发生了转机。当日,MSK研发的基因测序平台IMPACT获得美国食品药品监督管理局(FDA)批准,成为全球首个获批的多基因多癌种基因检测平台。IMPACT平台可一次性了解468个基因信息,检测精准度并不比同类平台高,获批的主要原因是MSK的研发与临床积累。“积累了大量、高质量的数据与案例,让FDA看到患者可以从这个平台中获益。”凯风创投管理合伙人黄昕对《财经》记者说。
MSK发表过23篇与IMPACT相关的文章。《自然·医学》上发表的一项研究显示,1万多名患者利用该平台做基因测序,发现近37%的患者有至少一种基因突变,约1000人能参与MSK不同靶向药物的临床试验。
追赶者F1CDx在同一月获得FDA批准,同时还获得美国医疗保险和医疗补助服务中心的平行审查批准。F1CDx由美国Foundation Medicine公司开发。
F1CDx平台仅覆盖324个基因,却是首个可针对所有实体瘤进行全面基因组分析的平台。FDA在评估其临床表现时,与辅助诊断试剂盒进行比较。结果显示,F1CDx能够准确检测出突变类型,且准确率达到94.6%。
FDA委员Scott Gottlieb在一份声明中写道,“FDA、CMS并行审查有助于加速新技术的上市,我们希望患者能够更快地获得突破性诊断,从而有助于医生制定优化的癌症治疗方案,最终改善医疗效果、降低医疗成本。”
企业贴钱赌未来
肿瘤医生认为:如果不做基因检测、接受靶向药物,王卓武甚至难以撑过一年。
之前,患者被查出癌症晚期时,不能做手术的,只能做放疗、化疗。由于不知道致病基因,癌细胞还是有扩散的可能,难以控制。像王卓武这样的四期非小细胞癌患者,一年生存率仅为15%-35%。
癌症,因基因突变导致。通过基因检测,锁定发生突变的基因,再配合靶向药物,可精准打击肿瘤。医生推荐王卓武去臻和科技开发的多基因肿瘤检测平台做检测,并根据检测报告服用靶向药物。在中国,可提供肿瘤基因检测的公司众多,除臻和科技,燃石医学、世和基因、思路迪、泛生子等均研发了多基因、多癌种的检测平台。
基因检测+靶向药物,被视为最有前途的癌症治疗方案之一,使这一行业的投资如火如荼。
第一梯队的五家公司,均融资亿元以上,多数是B轮。如泛生子在2018年1月4日宣布完成4亿多元的C轮融资;思路迪在2017年11月获得6.7亿元战略融资。
“国内公司做了大量的样本,但很多临床检测中心并不像美国那样,按照严格的标准来运行,做检测、做研究,不足以构成肿瘤基因测序具有明确临床效果的证据。” 臻和科技联合创始人兼首席科学官张恒辉接受《财经》记者采访时说。即便这个行业的领头羊,每月能完成1000例左右的检测样本,在数量上靠近MSK,但在质量上难达一样的高度。
MSK是一家拥有100多年历史的肿瘤医院,集临床与研究于一身,拥有120多家肿瘤研究实验室,自2014年便利用IMPACT平台进行基因检测,积累检测病例超过2万例。
没有MSK的先天优势,国内公司转而与医疗机构签约合作,三甲医院和肿瘤专科医院成为竞相争抢的“香饽饽”。检测公司标榜的签约医院数量越多,越吸引患者与资本。
国内各家公司的测序平台,技术差异不大,患者用谁的来检测,基本由医生说了算。于是,这个新兴行业也一头栽入医药销售的旧模式——由医生回扣构成的渠道费用陡然而升,挤压了原本不大的利润空间。
在这个长线战场,选手们鲜有盈利者。即使美国公司,亦是如此。Foundation Medicine财报显示,2017财年第二财季净利润为负4425.80万美元。“行业整体是靠贴补。只有等成本降下来,整个行业才会慢慢实现收支平衡,然后开始盈利。”张恒辉说。
黄昕测算,单月获取1000份以上检测病例的企业,能获得1000万元左右的收入,基本可以实现盈亏平衡,“在实现规模化经营后,整体收入去除掉30%左右的测序成本,20%-25%的渠道成本等,行业整体净利润在20%左右”。按这一测算,几家领先企业能达到盈亏平衡。
未来几年行业将会洗牌,只有建标准、获审批才能守住阵地。2017年12月16日,CFDA医疗器械技术审评中心审评专家周彩存,在上述学术会议上透露,CFDA明确了多基因检测方法2018年将获批。
对不良竞争者的担忧
即便整个行业都在贴钱提供服务,站入队伍的测序公司也心甘情愿,他们看重的是大Panel基因检测未来的商业前景。
“小Panel的NGS检测平台是过渡性的产品,要想让患者得到更好的服务,未来还是要以大Panel为主。”黄昕对《财经》记者分析。
目前在CFDA审评列队的,都是几个基因的小Panel测序平台。
llumina公司预测,肿瘤诊断与治疗的市场容量为120亿美元,将成为基因测序最大的应用市场。
Foundation Medicine在IPO以前,曾获得2.51亿美元投资,投资者包括Google、比尔·盖茨等;2015年,制药巨头罗氏公司斥资超10亿美元,获得该公司56%的股份。
中国的市场空间,可以拿基因检测的另一个阵地——产前基因检测(NIPT)做参考。
NIPT是国内至今唯一允许商业化的基因检测项目,每年销售额已超过30亿元。参与的公司有数百家,但市场被握在三五家领先企业手中。肿瘤检测的人数与NIPT相当,价格更高,而且患者在诊疗中不只做一次检测,肿瘤基因检测未来市场有望超百亿。
不过,由于标准、监管、技术等,这个超百亿元的蛋糕能否做成,还存有变数。
资本越来越关心的是整个生意的盈利能力。易凯资本高级经理张骁对《财经》记者分析,医生推荐、企业做第三方服务为主的销售模式,会持续一段时间,“这种模式上量慢,销售费用占比太高,对业内公司的业绩构成较大拖累,是制约行业发展的核心问题”。
不同于筛查类的检测,肿瘤基因检测最可贵的价值是用药指导,不同的肿瘤会出现更多差异化的产品。在张骁看来,肿瘤基因检测很难像NIPT一样,出现单一产品的爆款。
与NIPT相比,肿瘤基因测序产品太过复杂,需综合其他信息来判断临床价值,而NIPT的临床意义明确,并且有羊水穿刺作为金标准来对照;肿瘤基因检测产品,从Panel的设计,到每一个基因的测序深度与灵敏度等,都比NIPT复杂。
产品的复杂性,也给监管带来一定难度。“各个产品都不一样,能够给临床提供的价值无从判断,监管部门很难判断各家的技术是否达到理想的要求。”黄昕说。
迎接一个新兴行业,监管规范或迟或早总要推出。“期待一定监管规范的出台,至少不能让不良竞争者坏了行业。” 张恒辉说。
按照NIPT的经验,当用量达到一定规模后,会出现一定程度的不规范竞争,此时,行业和监管机构都希望规范市场,监管政策便会呼之而出。一如吸引各路眼球的共享经济。
“现在即便做不到规范与有序,产业公司、医院也应该更严谨一些,不能过于放松。”张恒辉对《财经》记者分析,目前行业里鱼龙混杂,甚至有原来做药品的渠道公司,在“两票制”施行、生意不好做后,尝试到上游找“货源”,靠关系卖到终端医院。
CFDA未来对肿瘤基因检测的监管模式,有可能模仿FDA的思路:如果哪家公司能超越只是跟某个科室、医生签约的模式,与一家大型医疗机构形成密切的合作,并且像MSK那样基于长期随访做出扎实的临床研究成果,证明检测服务对患者有明确的受益,其产品便可获批。
对竞争者们而言,打通医院壁垒,仅此一关,就是一个飞跃式的升级。
(本文首刊于2018年1月8日出版的《财经》杂志)
[注:本文部分图片来自互联网!未经授权,不得转载!每天跟着我们读更多的书]
互推传媒文章转载自第三方或本站原创生产,如需转载,请联系版权方授权,如有内容如侵犯了你的权益,请联系我们进行删除!
如若转载,请注明出处:http://www.hfwlcm.com/info/294229.html